II-Divers facteurs influent sur la durée de vie d'une bulle
Des bulles se forment naturellement à la surface des eaux. Mais celles-ci ne peuvent pas durer car seule l'eau les forme, il leur faut obligatoirement des tensioactifs, présents dans le savon.
Une bulle formée peut s'éclater par des perturbations extérieures, mais aussi par l'écoulement de l'eau dans sa sphère. Dans cette partie, nous avons donc cherché des composants et facteurs pouvant améliorer son maintien, puis nous les avons expérimentés.
1. Les tensioactifs
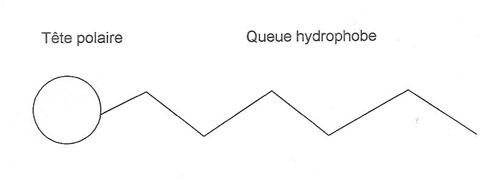
Une bulle a nécessairement besoin de tensioactifs (ou agents de surface), présents dans le savon, pour se former dans l'air et résister. Un tensioactif est une molécule amphiphile, c'est-à-dire, une molécule à la fois hydrophile (miscible à l'eau) et lipophile (retient les matières grasses). On retrouve chez ces tensioactifs une queue composée d'atomes de carbone, hydrophobe, qui est donc non-miscible à l'eau, reliée à une tête hydrophile.
Nous savons que plus il y a de tensioactifs, meilleur sera le maintien de la bulle. Scientifiquement, dans une solution aqueuse contenant des tensioactifs, il y a la concentration micellaire critique (CMC). Une micelle est un regroupement de tensioactifs qui forment un cercle dont le centre est l'extrémité de leur queue, et le contour leur tête. On parle de CMC lorsque les tensioactifs ne peuvent plus se placer à la surface de la solution car il n'y plus de place et qu'ils forment des micelles dans la solution. Ces tensioactifs stabilisent la structure de la bulle de savon.
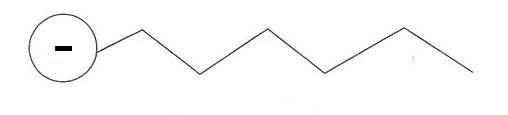
Tensioactif anionique : leur tête est chargée négativement.
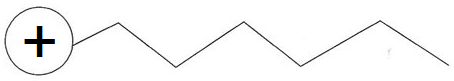
Tensioactif cationique : leur tête est chargée positivement.
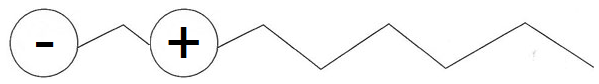
Tensioactif amphotère : il a deux têtes, l'une chargée positivement et l'autre négativement.
Tensioactif non-ionique : leur tête ne porte aucune charge.
Nous avons choisi du liquide vaisselle à la place du savon car il contient plus de tensioactifs. Notre liquide vaisselle contient trois de ces tensioactifs :
Il contient des tensioactifs (agents de surface) amphotères, non-ioniques et anioniques.
2. Des composants essentiels
Afin de réaliser la recette qui permet une durée de vie optimale des bulles, nous avons recherché quels seraient les composants adaptés, et les avons expérimenté pour tester leur efficacité.
Toutes nos expériences ont été réalisées dans les mêmes conditions : nous avons utilisé pour chacune exactement les mêmes composants, et avons formé les bulles dans une température ambiante se situant entre 20 et 21°C. Notre mode opératoire a toujours été le même : former 10 bulles à l'aide d'une paille sur une assiette, environ d'une taille égale, mesurer la durée de vie chacune à l'aide de chronomètres et calculer la moyenne des temps de vie de ces 10 bulles.
2.a. Recette témoin
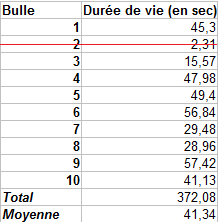
Sur le tableau ci-contre, nous avons barré la valeur de la durée de vie de la bulle 2 car c'est une valeur qui paraît aberrante comparée à toutes les autres. On remarque qu'aucune de ces bulles ne dure plus d'une minute et qu'en moyenne elles ne durent que 41.34 secondes.
Nous sommes alors partis à la recherche de composants améliorant nettement la durée de vie d'une bulle.
LES INCERTITUDES DE MESURE
Lorsque nous mesurons les temps de durée de vie des bulles, nous sommes soumis à des erreurs de mesure. Ici, nous parlons d'erreurs aléatoires qui sont définies par le temps de réaction pour appuyer sur le chronomètre, lors de la formation de la bulle et de son éclatement, et l'influence du milieu où l'on se trouve notamment.
Nous pouvons donc calculer l'incertitude des mesures, en utilisant la formule suivante :
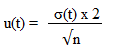
- u(t) : incertitude de la série de valeur en secondes.
- σ(t) : écart-type de la série de valeur, ici du temps de vie des bulles, en secondes.
- n : nombre de mesures prise en compte sur les mesures effectuées totales.
Grâce à la fonction "stat" de la calculatrice, nous avons calculé l'écart-type σ(t), qui est était d'environ 13 secondes, puis l'avons remplacé, tel que, n=9 dans la formule. Nous avons obtenu u(t)≃9 secondes.
Puis nous avons écrit le résultat avec la formule :
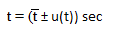
- t : temps que l'on peut qualifier de "réel", en secondes.
- t "barre" : moyenne de la série de valeur, en secondes.
- u(t) : incertitude mesurée, en secondes.
En utilisant cette formule, nous obtenons 41.34 sec ± 9 secondes, donc selon nos calculs, t peut être égal à 41,34 secondes avec un écart de 9 secondes permis.
2.b. La glycérine
Lors de nos recherches, nous avons découvert que la glycérine épaissit le mélange de la recette, ce qui ralentit le phénomène d'éclatement soit l'écoulement de l'eau dans la bulle.
Tout d'abord, la glycérine, ou glycérol, est un alcool d'origine végétale connu comme étant un liquide visqueux, incolore, inodore et sucré. Le glycérol est miscible dans l'eau et l'alcool mais pas dans les huiles. De plus, il fait office de bon solvant, grâce à ses trois groupes hydroxyles et est hygroscopique, c'est-à-dire qu'il absorbe l'eau se trouvant dans l'air, d'où ses vertus déshydratantes.
La glycérine sous quatre formes différentes :
Pour tester l'efficacité de la glycérine, nous avons ajouté à notre recette témoin (200 mL d'eau et 40 mL de liquide vaisselle) 20 mL de glycérine, soit deux fois moins que la quantité de liquide vaisselle. Cette recette est nommée la recette n°1.
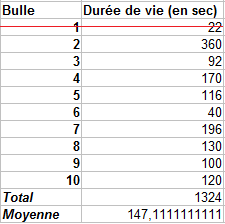
Toujours pour une question de valeur dite aberrante, nous avons supprimé la bulle 1, avec 22 secondes de tenue de nos calculs. Comme on le voit dans le tableau, toutes les bulles sauf la 6 dépassent 60 secondes, soit 1 minute en terme de durée de vie. La moyenne est d'environ 147 secondes, soit environ 2 minutes et 27 secondes.
Les bulles formées avec la recette témoin nous donnaient environ 41 secondes en moyenne pour leur durée de vie, contre 2 minutes et 27 secondes lorsqu'on y ajoute 20 mL de glycérine. Nous obtenons une nette augmentation de la durée de vie des bulles.
On en déduit donc que la glycérine joue un rôle important dans le maintien des bulles.
Lorsque nous avons formé ces bulles, nous avons pu constater qu'elles avaient un aspect visqueux, et certaines même rebondissaient sur une surface, comme ci-dessous :
2.c. L'eau déminéralisée
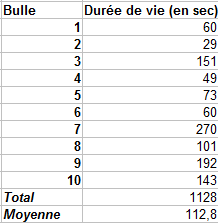
On obtient une durée de vie moyenne de 112.8 secondes, soit environ 1 minute et 53 secondes. Une forte augmentation de la durée de vie des bulles comparé à celle de la recette témoin où nous obtenions environ 37 secondes.
L'eau déminéralisée joue donc un rôle que l'on ne peut négliger dans la durée de vie des bulles.
De plus, le sucre qui a la propriété de ralentir l'évaporation de l'eau aide à faire tenir les bulles plus longtemps. Nous exploiterons cette donnée plus en détail dans la partie III.
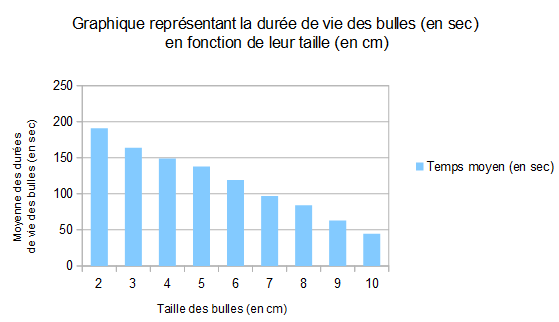
2.d. La taille des bulles
Nous nous sommes également demandé si la taille d'une bulle influait sur sa durée de vie.
Pour cela, nous avons réalisé des bulles de 2, 3, 4, 5, 6, 7, 8, 9 et 10 cm toujours selon le même procédé expérimental, sauf que nous avons pour chaque taille de bulle, tracé un segment de la longueur souhaitée. Ayant placés les milieux des segments, nous avons mis nos pailles sur ces derniers et avons soufflé jusqu'à ce que la taille des bulles corresponde aux extrémités des segments.
Voici les résultats :
On peut voir sur le graphique que plus la taille des bulles augmente, plus leur durée de vie diminue.
Plus la bulle sera grande et renfermera un grand volume d'air moins elle se maintiendra. A l'inverse, plus la bulle sera petite, et renfermera un petit volume d'air, plus elle se maintiendra.
On peut l'expliquer par la tension supercielle : en effet, comme vue précédemment, la tension superficielle augmente avec la taille de la bulle, plus celle-ci est importante plus la tension superficielle l'est ce qui demande plus d'énergie à la bulle pour se maintenir, donc une surface minimale lui en demande moins.
2.e. La température
Lorsque nous traitons d'eau, dans la membrane de la bulle, nous savons que celle-ci peut-être sous différentes formes : liquide, gazeuse ou solide et peut être soumise à différents changements d'état : condensation/sublimation, solidification/fusion, et vaporisation/liquéfaction. Ces changements d'états sont dus à la température à laquelle est placée l'eau.
Donc, la bulle va être elle aussi soumise à ces changements d'état, suivant la température où elles sont formées, ces changements vont s'opérer :
- Avec une température trop élevée, donc un temps chaud et sec : l'eau de la membrane de la bulle va s'évaporer et casser la bulle.
- Avec du vent, des courants d'air : la bulle va se déséquilibrer, et donc, dans la plupart des cas, s'éclater.
- Avec un temps froid et humide : le temps idéal pour former les bulles car celles-ci auront plus tendance à se solidifier et donc à se fortifier. On peut même observer des bulles formées sur la neige, se solidifier :
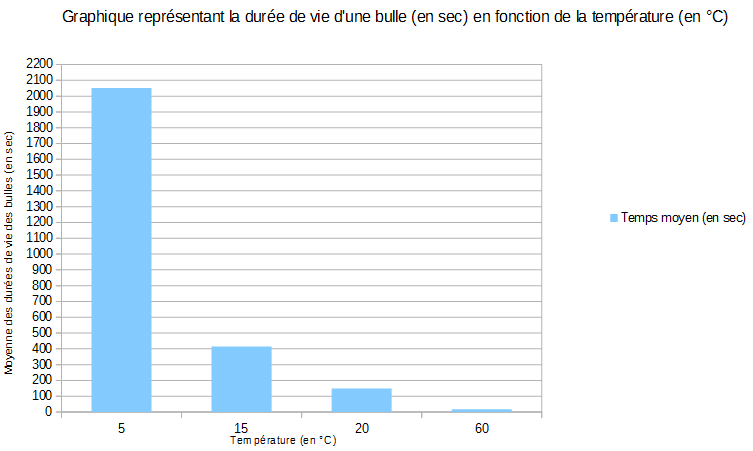
Nous avons voulu voir si la température jouait un rôle dans le maintien de vie des bulles. Pour cela, nous avons pris la recette n°1 (200 mL d'eau, 40 mL de liquide vaisselle et 20 mL de glycérine) et nous avons réalisé des bulles à l'exterieur, où il faisait 15°C contrairement aux 21°C de la maison. Nous avons également fait des bulles dans le congélateur à une température de -18°C, dans le frigo à 5°C et dans le four à 60°C.
Voici les résultats :
Sur notre graphique ne figure pas la moyenne de la durée de vie des bulles réalisées dans le congélateur à -18°C car, celles-ci n'éclataient pas avant que l'on ouvre le congélateur.
Néanmoins, on voit sur le graphique une durée de vie très élevée pour les bulles réalisées dans le frigo à une température de 5°C, comparée à celles des bulles formées à 15, 20 et 60°C.
Cette expérience confirme donc l'explication donnée précédemment : plus la température est faible et l'environnement humide, plus la bulle va résister.
En conclusion, nous avons pu trouver les composants de notre recette permettant une durée optimale des bulles de savon : le liquide vaisselle, la glycérine, l'eau déminéralisée et le sucre.
De plus, la taille des bulles et la température influent sur cette durée de vie.
Nous allons donc, dans la partie suivante, exploiter les composants, afin de trouver la quantité idéale à mettre dans notre recette pour chacun d'eux.